Nueva investigación aclara nuevos conceptos sobre la naturaleza dinámica de las proteínas tau, en hallazgos que pueden ayudar a desarrollar tratamientos que estabilicen la proteína antes de que adquiera la capacidad para agregarse y contribuir a la enfermedad de Alzheimer.

Investigadores del UT Southwestern’s O’Donnell Brain Institute, en Dallas, Estados Unidos, descubrieron que las proteínas tau pueden convertirse de una forma inerte a una forma mal plegada que siembra el crecimiento de agregados tóxicos que contribuyen a las alteraciones patológicas de la enfermedad de Alzheimer.
«Consideramos esto como el Big Bang de la patología de tau. Esta es una forma de mirar desde el proceso patológico desde el inicio», dijo en una declaración Marc Diamond, investigador principal, Ph. D., director del UT Southwestern’s Center for Alzheimer’s and Neurodegenerative Diseases.
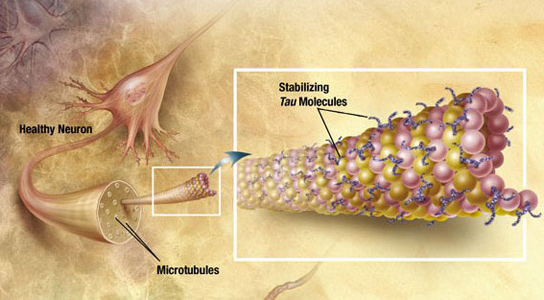
Los resultados, publicados el 10 julio en la versión electrónica de eLife, contradicen la creencia de que tau es una proteína intrínsecamente alterada sin una forma distintiva, señalan los investigadores.
«Aunque se ha considerado que el monómero de tau no tiene una estructura natural, nuestros hallazgos se contraponen a esta suposición e indican que el inicio de la agregación patológica podría comenzar con la conversión del monómero de tau de una forma inerte a una capaz de siembra«, escriben los investigadores.
Esta teoría implicaría que a partir de las «semillas» de proteínas agregadas se propaga la agregación de otras proteínas, existiendo en dos formas.
Implicaciones inmediatas
Los investigadores purificaron y caracterizaron las dos formas distintivas de tau a partir de fuentes recombinantes y cerebros humanos con enfermedad de Alzheimer. Observaron que la forma inerte no es tóxica, se mantiene estable durante periodos prolongados y no experimenta agregación con facilidad.
La forma capaz de siembra ayuda a convertir tau inerte en tau mal plegada que da lugar a agregados tóxicos al sembrarse o autoensamblarse. Tau puede modificarse lentamente desde la forma inerte hasta la forma capaz de siembra.
«La identificación de formas distintivas y estables de monómero de tau, incluidas algunas que tienen una capacidad singular para la siembra, influye directamente en la manera de comprender el inicio de la agregación de proteína en las tauopatías», señalan los investigadores.
«En lo personal, creo que esto es lo más importante que hemos realizado pues ofrece un esclarecimiento fundamental e importante de tau que tiene implicaciones inmediatas para el tratamiento y el diagnóstico», comentó Diamond a Medscape Noticias Médicas.
Si es posible detectar tau con capacidad de siembra en personas sanas, «podríamos prever la enfermedad y esto ha sido una meta importante en nuestro centro: desarrollar pruebas diagnósticas que pudieran aplicarse a una población sana, de una manera similar a la forma en que utilizamos la hemoglobina A1c para detectar diabetes en etapa temprana», señala Diamond.
Respecto a las terapias, «es posible desarrollar tratamientos dirigidos únicamente a las formas nocivas de tau que se acumulan por contraposición a todas las proteínas tau. Si la proteína tiene dos estructuras distintivas diferentes, entonces se puede vislumbrar la síntesis de pequeñas moléculas que se adhieran a la forma normal o saludable de tau y que la estabilicen antes de que se convierta en la forma perjudicial», añade el autor.

«Se sabe que las pequeñas moléculas pueden unirse a la conformación inerte de las proteínas que son propensas al plegamiento anormal, y de esta manera impiden el cambio en la configuración que conduce a las enfermedades amiloideas», señala Jeffery Kelly, Ph. D., de The Scripps Research Institute, en La Jolla, Estados Unidos, en un editorial complementario publicado con el estudio.
«Por ejemplo, la transtiretina es otra proteína con dos formas de plegamiento, y cuya conformación tóxica daña diversos sistemas nerviosos y el corazón. Sin embargo, los fármacos conocidos como estabilizadores cinéticos pueden hacer más lento el proceso degenerativo al incrementar la población de la conformación plegada en forma adecuada», explica Kelly.
Señala que los tres estudios clínicos controlados con placebo han demostrado que las moléculas pequeñas, como los fármacos tafamidis y diflunisal, pueden unirse a la forma no patógena de la transtiretina y estabilizarla, «lo que impide que la proteína se convierta en la conformación que inicia agregados y origina alteraciones degenerativas».

«Esto sugiere que debe ser posible crear estabilizadores cinéticos similares a la proteína tau y ofrecer mejores tratamientos para patologías como la enfermedad de Alzheimer», concluye.
Esta investigación fue financiada por el National Institutes of Health, la Rainwater Charitable Foundation y la Effie Marie Cain Endowed Scholarship. Diamond y Kelly han declarado no tener ningún conflicto de interés económico pertinente.











